激素驱动的癌症,如乳腺癌和前列腺癌,通常依赖于一种难以针对的蛋白质,称为叉头框蛋白1(FOXA1)。FOXA1的突变可以使这些类型的癌症生长和繁殖。今天,FOXA1因很难用药物阻断而臭名昭著——但这种情况可能很快会改变。斯克里普斯研究所的科学家们已经确定了FOXA1上的一个关键结合位点,这可能为未来的癌症治疗铺平道路。
研究团队的发现已发表于2024年10月15日的《分子细胞》期刊上,同时还绘制出药物样小分子化合物——称为小分子——与该蛋白的相互作用方式。在大规模检查蛋白质相互作用时,作为共同通讯作者的Benjamin Cravatt博士(生物学及化学Norton B. Gilula讲座主)实验室里的研究人员确定了小分子实际上可以与FOXA1相互作用。“FOXA1历来被认为是不可药及的,”Cravatt说。
“人们认为它缺乏小分子药物可以结合的表面,这可能是为什么很难以针对该蛋白进行治疗。”发现之后,Cravatt的实验室与Michael Erb博士的实验室合作,以更好地理解这些分子如何可能影响FOXA1的功能。Cravatt和Erb都使用了两种形式的基于活性蛋白质谱(ABPP)技术,这是Cravatt的实验室首创的,用于在全球范围内捕捉蛋白活动性。
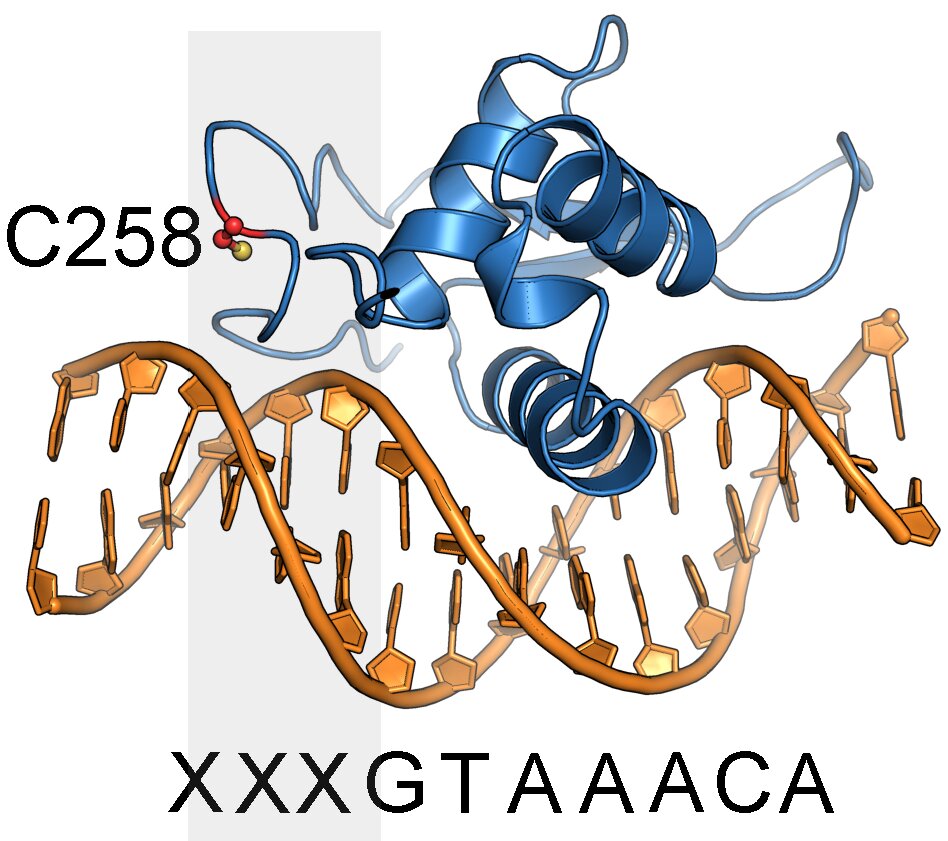
双重方法不仅允许他们确认小分子是否可以结合FOXA1,还帮助他们确定确切的结合位点。Erb及其小组特别感兴趣的是特定基因如何通过被称为转录因子的蛋白质被激活(“打开”)或被抑制(“关闭”),以及这如何导致引发癌症的细胞状态。像FOXA1这样的转录因子结合到DNA的特定区域,并控制基因是否被激活或被抑制。
这种调节对于细胞如何运作和响应变化至关重要——例如在激素驱动的癌症中,这些癌症往往依赖于FOXA1维持其生长。“FOXA1是基因控制的主调节因子,或者我们称作为血统定义因子,”这项研究的共同通讯作者、化学系副教授Erb说。“我们发现FOXA1上有一个特定位点可以与小分子结合,这一发现极为重要,因为像FOXA1这样的转录因子不仅是癌症的理想目标,还有许多其他疾病。”
由于在转录因子上找到小分子结合位点非常罕见,这一发现是意料之外的。“一个常见的类比是药物就像钥匙插入锁中结合到蛋白质上,但普遍的态度是,大多数转录因子没有可解锁的结合位点,”Erb补充说。“FOXA1的结合位点就像一个隐藏的锁;如果没有如今的ABPP技术,很难想象我们如何会发现它。”另一个令人惊讶的发现是:
FOXA1通常结合到DNA碱基的独特序列上以控制基因调节——但将FOXA1与小分子结合改变了它的偏好序列,从而使该蛋白能够靶向于不同于通常的基因。这一发现可能有助于未来的研究人员理解这些分子如何影响癌症中的基因调节。如果小分子改变了FOXA1的DNA偏好,它们可能会影响哪些基因被激活或关闭——可能影响癌症的增长。“我们发现小分子可以影响FOXA1解释基因组信息的能力,”Erb说。
此外,研究小组确定FOXA1中的某些突变影响了小分子可以附着在蛋白上的附近区域。这些突变改变了FOXA1与DNA的相互作用方式——与小分子所产生的影响完全一样。“这表明,癌症相关突变的热点也是小分子结合事件的热点,”Erb指出。与最初的想法相反,研究人员发现小分子不能单独附着在FOXA1上。
相反,它们只能在蛋白质已经与DNA序列结合的情况下绑定到FOXA1上——这意味着小分子作为癌症治疗的效果可能依赖于FOXA1与DNA的相互作用。展望未来,Erb和Cravatt计划探索将FOXA1配体优化为其功能和癌症生长的拮抗剂,并使用ABPP寻找FOXA1之外当前被视为不可药及的转录因子上的小分子结合位点。
“现在我们已经创建了用于研究FOXA1的化学探针,我们希望我们的研究能够激发开发能够以该蛋白为目标的药物,”Cravatt说。
除了Cravatt和Erb,该研究的作者还包括Scripps Research的Sang Joon Won, Yuxiang Zhang, Christopher J. Reinhardt, Lauren M. Hargis, Nicole S. MacRae, Kristen E. DeMeester, Evert Njomen, Jarrett R. Remsberg和Bruno Melillo。