暴露影响和优先效应对婴儿肠道微生物群的影响
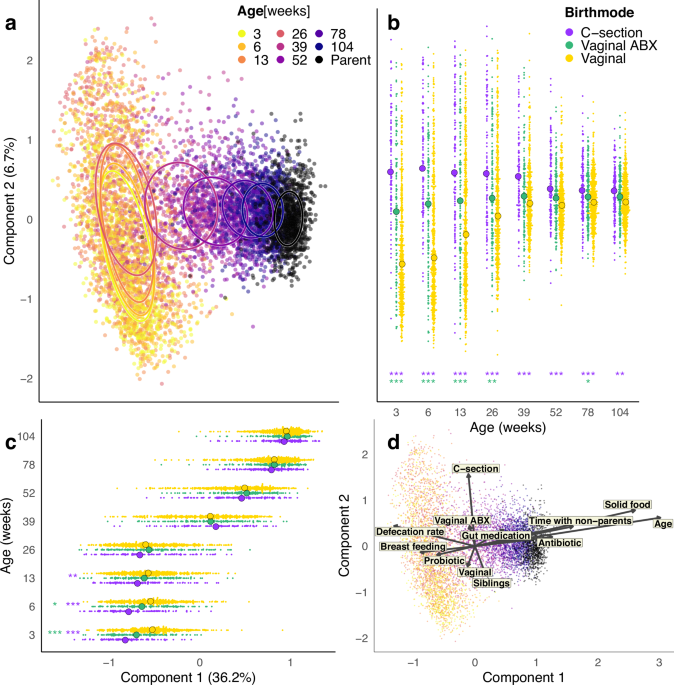
利用984名婴儿(50.7%男性,49.3%女性)、768名母亲和515名父亲的16S rRNA基因扩增子序列,共7211个粪便样本,通过使用log-Pearson距离进行无监督主坐标分析(图1a),我们观察到肠道微生物群组成中存在明显的年龄梯度,婴儿的肠道微生物群在前两年中逐步接近但未达到类似成年人的组成(年龄值p=0.001,R2=0.18;
104周龄vs成人p=0.001,R2=0.21)。在前6个月(26周)内,婴儿肠道微生物群组成在个体间差异很大,但此后趋于一致(图1a–c)。出生方式与发育相关(图1b, c)。在未暴露于产时抗生素的经阴道出生婴儿(VD)中,我们观察到前26周内主成分(PC)2得分增加,而26至104周内PC1得分增加(图1b, c)。
剖宫产(CS)出生及较少暴露于产时抗生素的经阴道出生(V-ABX)改变了这一模式,这些婴儿在3周时PC2得分就已显著较高(CS vs VD,p <0.001在3-78周;p=0.003在104周),但在早期周内PC1得分始终较高(PC1得分CS vs VD,p < 0.01)。 为了识别影响肠道微生物群的因素(补充数据1),我们分析了背景变量与排序的关联(envfit)并进行了变量的置换多元方差分析(adonis2)(图1d)。影响PC1得分的主要决定因素是年龄(adonis2中R2=0.178)。 此外,固体食物的摄入(R2=0.02)、抗生素的使用(R2=0.0008)、与非父母看护者共处的时间(R2=0.005)和肠道靶向药物的使用(泻药/防胀气/止泻药/便秘药,每个R2=0.004)在调整年龄后显著与PC1相关。母乳喂养(R2=0.004)和益生菌的摄入有相反的关联,但后者在多变量模型中不显著(p=0.99)。 影响PC2得分的主要因素是出生方式(R2=0.02)及有兄弟姐妹(R2=0.007)。为了评估微生物群发育的可预测性,我们针对PC得分通过年龄建立了多变量回归模型,并量化每个时间点各因素解释的方差。在前26周内,影响肠道微生物群组成的最重要因素是出生方式,全年内是排便频率,而从1至2岁(52-104周)是饮食和家庭构成(图2a)。 母亲特征在所有时间点都有适度且一致的影响,而母亲微生物群组成(母亲的PC得分)在26周时变得有影响(解释1.22%的变化,p=0.017),且随时间增加(104周为5.12%,p < 0.0001)(图2a)。将婴儿的前一个时间点的微生物群组成(PC得分)加入模型,发现这是决定当前组成最有影响的因素,解释了6周样本中59%的变化(图2b,补充图1a,p < 0.001)。 包括前一个组成后,出生方式的影响减少或消失,这表明出生方式对肠道微生物群的影响是由于其对初始定殖的影响。通过用3周的PC得分替换前一个时间点的PC得分测试初始组成的影响(图2c,补充图1b)。初始组成在前26周内影响很强(超过10%),在52周时仍显著(1.7%,p < 0.001),强调了初始接种的长期重要性(图2b, c, 补充图1a, b)。 通过模型模拟在有完整时间序列和完整背景信息的婴儿(N=98)中测试肠道微生物群发育的可预测性。根据背景信息(图2b)和3周的微生物群组成使用模型中的参数估计值模拟每个婴儿随时间的PC得分。模拟的微生物群发育与观察到的模式非常接近,相关性为0.84,表明早期生命微生物群发育的可预测性高,随机性适中。通过在每个时间点通过envfit投影到特定年龄上的排序来进一步评估暴露的影响。 高母亲BMI、长时间破膜、高妊娠年龄和配方奶喂养与高排便率在前26周内对肠道微生物群的影响类似但较弱于剖宫产和V-ABX(补充图2)。采样前母婴益生菌使用的影响类似于母乳喂养,而高食欲、有兄弟姐妹和使用安抚奶嘴与9个月(36周)及以后配方奶喂养的微生物群组成相关(补充图2)。有些关联可能部分由混杂因素驱动。 例如果,排便率(表示转运时间)与母乳喂养强相关——母乳喂养在6周(p=0.012)和12周(p=0.017)时与高排便率相关,但在36周(p=0.035)、78周(p=0.007)和104周(p=0.006)时却有相反的关联。食欲高的婴儿在78周(18个月)更可能喂配方奶(p<0.05)。PC得分与个体微生物类群相关,以识别总体微生物组成的指示生物种群。 3-26周为双歧杆菌,39周为短芽孢杆菌,12个月(52周)为科林氏菌属,78周为肠球菌属,104周为克里斯滕森氏菌属(补充图2)。然后我们进一步深入研究了最重要暴露的分类学关联。丰富的微生物群可分为随年龄自然下降的(双歧杆菌科、拟杆菌科、肠杆菌科),在26-52周达到顶峰的(韦荣氏菌科)或随年龄增加的(瘤胃球菌科、厚壁菌科)(图2d)。这些模式受到婴儿暴露的影响。 剖宫产生育强烈相关(p < 0.001)于拟杆菌属、副拟杆菌属、双歧杆菌属和科林氏菌属的定殖延迟(图2d,补充数据2)。V-ABX对革兰氏阳性生物主要具有剖宫产样影响(图2d)。 母乳喂养在3和26-52周时与增加乳酸杆菌科相对丰度(p < 0.001),在6周时为拟杆菌科(p < 0.001)和36-52周为双歧杆菌科(p < 0.01)相关,双歧杆菌科在前两年内相对丰度一致减少(p < 0.001)。配方奶喂养与微生物群成熟的加速相关,表现为肠杆菌科的快速减少、韦荣氏菌科的早期顶峰以及厚壁菌科的早期增加(图2d,补充数据3)。 在生命早期几周内,有兄弟姐妹与双歧杆菌科(p < 0.0001)和乳酸杆菌科(p=0.007,图2d)的相对丰度增加相关。兄弟姐妹对双歧杆菌科的影响在经阴道出生时3周就已显现(p < 0.0001),但在剖宫产生育中不明显(p=0.736,补充数据4),这表明该影响是通过母亲肠道微生物群介导的。确实我们发现,多产母亲的粪便中双歧杆菌丰度显著高于初产母亲(p < 0.05)。 在26周后,兄弟姐妹的影响更为广泛,与瘤胃球菌科的相对丰度增加联系在一起,并使厚壁菌科减少(图2d)。此外,绿色粪便颜色在6和13周与双歧杆菌相对丰度减少相关(p=0.007)。通过前一时间点的分类组成作为解释变量进行多元方差分析识别出每个时间点影响肠道微生物群发育最重要的微生物类群。 双歧杆菌和拟杆菌在前2年内最具影响力,尤其是在前几个月影响很强,而韦荣氏菌和科林氏菌在52-78周成为主要影响因素(补充图3)。在前26周内,某一时间点的双歧杆菌科和拟杆菌科相对丰度与下一时间点的克雷伯氏菌科、肠杆菌科和瘤胃球菌科的相对丰度呈负相关,与乳杆菌、放线菌和拟杆菌门成员呈正相关(补充图4)。 婴儿的微生物群类型 为了识别婴儿主要的微生物群类型,我们使用K均值聚类和log-Pearson距离对婴儿样本在属水平上进行了聚类,识别出四种微生物群类型(图3a)。我们同时测试了额外的距离度量:Bray-Curtis、Jaccard和Aitchinson(补充图5a–c)。不论距离度量如何,微生物群类型是相同的,并且各度量之间总体相似。 群体类型1和2(C1和C2)特征为前26周的微生物群,C3常见于39-52周,其后为C4。C1以双歧杆菌(相对丰度39.2%)和拟杆菌(12.8%)为主,放线菌和拟杆菌门其他成员共同占相对丰度的50%以上平均值(图1b)。群体类型2(C2)几乎没有双歧杆菌(4.8%),克雷伯氏菌科(13.4%)和肠杆菌科(25.7%)相对丰度高。 在群体类型3(C3)中,双歧杆菌科(27.3%)、厚壁菌科(18.5%)和韦荣氏菌科(20.1%)是主要的家族,而群体类型4(C4)以厚壁菌科(30.0%)和瘤胃球菌科(30.0%)为主(补充数据5)。微生物丰富度在不同微生物群类型间显著变化,在C4中最高,在C2中最低(图3c),并且与婴儿年龄总体呈增加关系。潜在的致病生物相对丰度在C2中最丰富(图3d)。 不同群体类型的粪便颜色显著不同(p < 0.0001,χ2测试,补充图6),C1和C2更有可能具有黄色和绿色粪便,而C3和C4多见于棕色粪便,代表固体食物增加后婴儿饮食中粪便组成的变化。在早期月份(C1和C2)中,绿色粪便更可能发生在C2(p < 0.0001)。为了解释婴儿的群体类型,我们使用递归分区。一个包含4个变量的模型解释了56%的群体类型变化(图4a)。年龄是最重要的解释变量。 早期社区,C1和C2取决于出生模式、兄弟姐妹和曾服用含双歧杆菌的益生菌(采样前服用过),C1是未暴露于产时抗生素的经阴道出生婴儿在前6个月的典型模式。在6个月之前,剖宫产生育的婴儿通常为C2,但到6个月时那些有兄弟姐妹的常转为C1。V-ABX婴儿的样本在6个月前也归类为C2,除非他们接受过含双歧杆菌的益生菌或有兄弟姐妹,这有助于他们转为C1。在9个月时,大多数婴儿处于C3。 12个月时,有兄弟姐妹促进了早期转向C4。12个月后,大多数婴儿处于C4(图4a)。我们测试了每个时间点的微生物群类型与2年和5年健康结果的关联,发现C2与不良健康结果(尤其是过敏性疾病)的风险增加相关(图4b,补充图6,补充数据6)。在6个月前处于C3的孩子有较高的过敏性疾病风险和5岁时身高与年龄Z评分< -1标准差。 早期转向C4(12个月)与2岁时身高与年龄Z评分< -1标准差相关,但在2岁时,C4与同时诊断的哮喘负相关。在12个月时,C1与曾患胃肠感染相关。发展轨迹 由于在个别婴儿中微生物群发育被发现遵循一致且可预测的模式,我们利用基于组的轨迹建模识别不同的微生物群发育模式。识别出五种不同的发展轨迹,主要在前6个月表现出差异。 轨迹1(T1)是最常见的(N=388,占47%),特征是前6个月稳定在C1,9个月转为C3,12-18个月转为C4(图5a)。这些婴儿高初始相对丰度的双歧杆菌逐渐减少,最初被韦荣氏菌取代,然后被粪杆菌和厚壁菌科成员取代(补充图8a)。轨迹2(T2,N=95,占11%)最初处于C1,但转向C2再转向C3(图5b),显示双歧杆菌迅速减少和梭菌和克雷伯氏菌暂时增加(图5b,补充图8b)。 轨迹3(T3,N=78,占9%)始于C1,但在前6个月反复在C1和C2间振荡(图5c,补充图8c)。T3的反向模式由T4(N=151,占18%)代表,婴儿从C2开始,在前6个月间在C1和C2间振荡,显示出6-9个月的双歧杆菌顶峰(图5d,补充图8d)。轨迹5(T5,N=116,占14%)在前6个月始终处于C2,克雷伯氏菌和克雷伯氏菌相对丰度高(图5e,补充图8e)。 内部时间的一致性显示,微生物群发育在6-9个月最为迅速,3-12周内T3婴儿显示最大波动,9个月时T2显示最大波动。在T1婴儿中,微生物群组成通常最稳定。我们将轨迹与以前收集的在全球约5732名婴儿(30个研究)在前两年内的平均婴儿肠道微生物群组成数据进行比较(三岭纲/门水平)(图5f)。T1最接近全球正常发育模式,而T2和T3最类似于平均受阻模式。 使用χ2检验评估背景因素与轨迹成员的关联(图5g)。轨迹1-3与经阴道分娩相关,而T4和T5与剖宫产及产时抗生素预防相关。与其他轨迹相反,T1与有兄弟姐妹、住独栋房屋和在前12个月未喂配方奶相关。T2婴儿的C2转换可能由配方奶喂养或缺乏兄弟姐妹促成,并可能反映在症状上,因为这些婴儿比其他婴儿更有可能接受益生菌。 T3的C1和C2波动的唯一可识别原因是缺乏兄弟姐妹,可能与住房类型所示的更低社会经济地位有关。可能与直觉相反的是,T3婴儿在前3个月接受抗生素的可能性较低。T4中的自发微生物群校正可能由母乳喂养或与更高社会经济地位相关的其他因素驱动。